고정 헤더 영역
상세 컨텐츠
본문
초록
종래의 LiPF6/카보네이트계 전해질은 흑연(Gr)계 리튬(Li) 이온 배터리(LIB)에 안정적인 고체 전해질 상호상(SEI) 층이 흑연 표면에 형성되고 장기 사이클링 안정성을 가능하게 하기 때문에 30년 이상 널리 사용되어 왔다. 그러나 이러한 전해질 중 일부는 충방전 과정에서 큰 부피 변화를 나타내는 Li 금속 음극(LMA : Lithium Metal Anode) 및 실리콘(Si)과 같은 다른 음극에 필요한 보다 엄격한 조건 하에서 안정적이다. 최근 Li 금속 배터리(LMB) 및 Si계 LIB를 안정화시키기 위해 많은 상이한 접근법이 개발되었다. 이러한 측면에서 국부적인 고농도 전해질(LHCE)은 독특한 이점을 가지고 있다: 이들은 넓은 전기화학적 전위창(electrochemical potential window)에서 안정적일 뿐만 아니라 LMA 및 Si 음극 표면에 안정적인 SEI 층을 형성하여 장기 수명 안정성을 가능하게 할 수 있다. Gr 음극에 형성된 초박막 SEI 층은 또한 종래의 LIB의 안전성 및 고율 충방전을 향상시킬 수 있다. 본 논문에서는 LMB 및 LIB 모두에서의 설계 원리 및 응용을 포함하여 LHCE에 대한 최근 연구에 대해 간략하게 요약한다. LHCE의 미래 개발에 대한 관점도 논의된다. © 2021 The Author(s). IOP Publishing Limited에 의해 전기화학회를 대신하여 출판되었다. 이는 원본 작품이 적절하게 인용된다면 어떤 매체에서도 작품을 무제한으로 재사용할 수 있는 Creative Commons Attribution 4.0 License(CC BY, http://creativecommons.org/licenses/ by/4.0/) 조건에 따라 배포된 오픈 액세스 기사이다.
전해질이 리튬(Li)-이온 배터리(LIBs)의 안정적인 작동에 중요한 역할을 한다는 것은 잘 알려져 있다.1,2 전해질이 리튬(Li)-이온 배터리(LIBs)의 안정적인 작동에 중요한 역할을 한다는 것은 잘 알려져 있다.1,2 예를 들어, 흑연(Gr) 음극은 Gr의 그래핀 층으로 프로필렌 카보네이트의 공동 삽입 때문에 발생되는 Gr 박리로 때문에, LIB 연구의 초기 단계에서 사용되었던 프로필렌 카보네이트(PC)계 전해질은 사용하지 않는다. 그 후 Dahn 등은 에틸렌 카보네이트(EC)가 초기 삽입 과정에서 분해될 수 있으며, 그 박리를 방지하기 위해 Gr 표면에 안정적인 고체 전해질 상호상(SEI) 층을 형성할 수 있다는 것을 발견하였다.4 이러한 돌파구로, 카보네이트 기반 전해질은 1991년 초부터 휴대용 전자제품 및 전기 자동차를 포함한 생활의 많은 측면을 관통하는 LIB에 널리 사용되었다.5 최근, 고에너지 배터리에 대한 수요가 계속 증가하고 있으며, 연구자들은 이제 고전위에서 작동하는 전극과 함께 사용할 수 있도록 전해질의 전기화학적 창을 확장하려고 한다. 이러한 전극은 매우 낮은 환원 전위(-3.040 V vs. 표준 수소 전극)를 갖는 Li 금속 음극(LMA) 및 높은 산화 전위(>4.5 V 대 Li/Li+)를 갖는 새로운 양극을 포함한다.6 그러나, LIBs에 일반적으로 사용되는 종래의 전해질(전형적으로, 1-1.2 M 리튬 헥사플루오로인산염(LiPF6)은 수지상 Li의 성장 및 LMAs.6,7의 매우 낮은 쿨롱 효율(CE)때문에 Li 금속 배터리(LMBs)에 적합하지 않다. 반면에, 종래의 LIBs에 사용된 대부분의 음극 재료(예를 들어, Gr)는 비교적 작은 부피 변화(전형적 <10%)만을 나타내므로, 이러한 전극에 형성된 SEI 층의 기계적 강도가 요구되지 않았다. 그러나, LMA 및 실리콘(Si) 애노드와 같은 일부 고용량 전극 재료는 사이클링 동안 예외적으로 큰 부피 변화(Si의 경우 400%, LMA의 경우 훨씬 더 많은)를 나타낸다.
최근 몇 년 동안 LMB 및 Si 기반 LIB를 안정화하기 위한 새로운 전해질을 개발하기 위해 많은 연구가 수행되었다. 10–12,13–15 Yamada et al. 는 디메틸 카보네이트(DMC) 중 5.5 M 리튬 비스(플루오로술포닐)이미드(LiFSI)로 구성된 초농축 전해질 [또는 고농도 전해질 (HCE)]이 5볼트급 음극으로 안정적일 수 있으며, 또한 알루미늄 (Al) 집전체의 부식을 방지할 수 있다는 것을 발견했다.(LiFSI 염이 저농도 전해질에 사용될 때 Al 부식은 심각한 문제이다.) 11 Qian et al. 는 에테르 기반 HCE [즉, 1,2-디메톡시에탄 (DME) 중 4 M LiFSI]가 LMAs의 CE를 99.2%로 크게 증가시킬 수 있다는 것을 발견했다. 16 Wang and Xu et al. 는 LMAs 및 Si 양극의 안정적인 작동을 가능하게 하는 일련의 불소화 전해질을 개발했다. 13,15,17–19 Watanabe's group 묽은 이온성 액체 전해질을 Li-S 배터리에서 하이드로플루오로에테르 (HFE)로 희석했다. 20 그들은 HFE의 첨가가 glyme-Li-salt 용융 복합체의 용매 구조를 파괴하지 않는다는 것을 발견했다. Doi et al. 는 4볼트급 LMBs.21 에 대해 PC에서 불소화-에테르-희석 농축 LiBF4를 사용했다. 그러나 이러한 희석된 HCE는 LMAs와 고전압 음극 모두에서 안정적이지 않다. 최근에 우리는 국부적인 고농도 전해질 (LHCE)의 개념을 기반으로 하는 일련의 전해질을 개발했다.9,12,22–27 이 개념은 음극으로 Li 인터칼레이션 화합물을 사용하는 LMB, 12,28 Si 기반 LIBs,29,30 Gr 기반 LIBs,31,32 Li-O2 배터리,33,34 및 나트륨 (Na) 금속을 포함한 광범위한 배터리 화학 분야에서 사용되었다. LHCE의 기본적인 설계 원리가 먼저 논의될 것이다. 이들 전해질은 저온에서 불연성 및 안정성을 갖도록 조정될 수 있다. 다양한 배터리 화학과 함께 이들 전해질의 적용도 검토될 것이다. LMA, Si 애노드, Gr 애노드 및 고전압 캐소드를 갖는 이들 전해질의 안정성 이면의 기본적인 메커니즘도 논의될 것이다.
Design Principle of LHCE
그림 1은 여러 전해질의 일반적인 구조와 이러한 다른 구조가 LMAs로 크게 다른 안정성을 갖는 이유를 보여준다. 기존의 희석 전해질(도 1a) 및 HCE(도 1b)와 비교할 때, LHCE의 주요 특성은 독특한 용해 구조이며, 고농축 염-solvent 클러스터가 nonsolvating 용매(희석제) 분자에 분포되어 있다(도 1c). 따라서, LHCE는 전형적으로 이온 전도성 염, 용매 및 nonsolvating 희석제의 세 가지 주요 성분을 갖는다. 경우에 따라, 특정 Cell chemistry에 대한 전해질을 튜닝하기 위해 추가 첨가제가 도입된다. 본 절에서는 LHCE의 합리적인 설계에 대하여 각 구성요소의 효과와 구성요소의 선택/최적화 원리를 포함하여 논의하고자 한다. 이를 위해, 적절한 염은 선택된 용매에 양호한/높은 용해도를 가져 HCE를 형성할 것이다(보통 염 농도 > 3 M). 거의 모든 용매-solvent 분자는 염의 양이온에 배위되어 전해질에 자유 용매 분자가 거의 또는 전혀 남아 있지 않아야 한다. 이는 염 농도가 약 1 M이고 충분한 용매 분자가 도 1a에 나타낸 바와 같이 용매 분리 이온 쌍(SSIP) 구조를 보장하는 기존의 전해질과 완전히 다르다. 대신에, HCE 및 LHCE에서 용매-solvent 분자의 결핍 때문에, Li+ 이온은 용매 분자를 공유하여 개별 용매 외피를 형성하도록 강요된다. 많은 부분의 음이온은 도 1b 및 1c에 나타낸 바와 같이, 접촉 이온 쌍(CIP) 및 양이온-anion 응집체를 형성하면서 Li+ 이온에 공동으로 배위된다. 전기화학 디바이스에 사용되는 염을 전도하기 위한 최소 요구사항은 염 용해도, 해리 능력 및 활성 전극, 용매 및 분리막, 전극 기재 및 셀 패키징 재료와 같은 다른 셀 구성요소와의 화학적 불활성을 포함한다. 이러한 요구사항은 후보 염을 크게 제한한다.1 LIB에 일반적으로 사용되는 대부분의 리튬 염은 리튬 헥사플루오로인산염(LiPF6), 리튬 퍼클로레이트(LiClO4), 리튬 헥사플루오로아르세네이트(LiAsF6), 리튬 테트라플루오로보레이트(LiBF4), 리튬 비스(옥살라토)보레이트(LiBOB), 리튬 디플루오로(옥살라토)보레이트(LiDFOB), 리튬 트리플루오로메탄설포네이트(LiTf) 및 리튬 비스(트리플루오로메탄설포닐)이미드(LiTFSI) 및 이의 유도체들과 같은 복합체 음이온을 기반으로 한다.1 HCE 및 LHCE에서 높은 용해도 및 해리 상수에 대한 필요성은 상기 언급된 대부분의 리튬 염을 배제한다. 지금까지 리튬 비스(플루오로술포닐)이미드(LiFSI), LiTFSI 및 리튬 비스(펜타플루오로에탄설포닐)이미드(LiBETI)와 같은 이미드 음이온을 기반으로 하는 염은 HCE 및 LHCE에서 가장 적합한 염이다. 기존 전해질의 SSIP에서 CIP 및 HCE 및 LHCE의 응집체로 용해 구조가 변경됨에 따라 LUMO가 용매에서 음이온으로 이동한다. 예를 들어, 1.2 M LiFSI/DMC의 희석 전해질에서 5.5 M LiFSI/DMC의 HCE와 1.2 M LiFSI/DMC-bis(2,2,2-트리플루오로에틸) 에테르(BTFE)(1:2 몰)의 LUMO는 희석 전해질의 DMC에서 HCE(1e) 및 LHCE(1f)에서 FSI-로 이동한다.12 따라서 음이온은 먼저 분해되어 무기물이 풍부한 것으로 알려져 있는 염 유래 SEI를 형성한다. LiFSI는 많은 경우에 FSI-음이온으로부터 유래된 SEI가 매우 안정적이고 사이클링에 대해 강력하기 때문에 LHCE에 매우 유리하다. 흥미롭게도, 이러한 시스템의 용매 결핍의 결과로 인해 기존 희석 전해질에서 이미드계 염의 적용을 크게 제한하는 심각한 Al 부식은 더 이상 HCE 및 LHCE에서 관심사가 아니다. 또한, 이러한 염은 LIB에서 널리 사용되는 LiPF6보다 더 나은 열적 안정성을 제공한다.
염보다 용매에 대해 더 많은 선택이 가능하다. HCE 및 LHCE에서 이러한 용매에 대한 기본 요구 사항은 기존 전해질의 요구 사항과 거의 동일하다: 1) 충분한 염을 용해하기 위한 높은 유전율; 2) 다른 셀 성분과의 우수한 불활성; 3) 넓은 액체 온도 범위 및 4) 용이한 이온 수송을 위한 낮은 점도. 따라서, 탄산염, 카르복실레이트, 에테르, 인산염, 니트릴 및 설폰을 포함한 기존 전해질에 사용되는 비양성자성 용매는 모두 HCE 및 LHCE의 좋은 용매 후보이다. 4.0 V (vs Li/Li+)를 넘어 불안정한 것으로 널리 알려져 있는 1,2-디메톡시에탄 (DME)과 같은 에테르는 4.5 V만큼 높은 전압에서 안정성을 입증했다. 더욱이, 거의 모든 용매가 내부 용매 피복에서 Li+ 이온에 배위되기 때문에, Li+ 이온 배위 용매의 HOMO 에너지는 자유 용매 분자의 에너지보다 낮다. 이러한 현상은 전해질의 산화 안정성을 상당히 향상시킨다. 이러한 경우에, 용매의 선택은 저-농도 전해질의 선택보다 더 광범위해지고 있다.
에테르는 일반적인 전해질 용매 중에서 Li 금속에 대해 가장 우수한 화학적 안정성을 갖는 것으로 알려져 있기 때문에, 이 발견은 에테르 기반 HCE와 LHCE가 4.5 V까지 고전압 LMB의 안정적인 사이클링을 가능하게 할 수 있다는 돌파구이다. Gr 및 Si 음극의 경우, EC는 SEI 형성에서 중요한 역할 때문에 기존 전해질의 용매 혼합물에서 필수적인 것으로 간주되었다. 그러나 EC 용매가 없는 LHCE는 또한 LIBs.29,31,32에서 매우 안정적인 사이클링을 나타냈다. 동시에, Li+ 이온으로 조정하면 용매 증발이 감소하며, 이는 특히 DME 또는 DMC와 같은 휘발성이 높은 용매에서 전해질의 열적 안정성을 증가시키기 때문에 큰 이점이다.
게다가, 트리에틸 포스페이트(TEP)와 같은 불연성 용매도 LHCE들에 대한 좋은 선택이다. 점화 시험들은 TEP에 기초한 LHCE들이 불연성이라는 것을 증명한다. 이들 LHCE들은 LMB들과 LIB들 모두에서 우수한 전지 성능을 보여주었다. 용매 효과들의 요약을 표 I에 나타내었다. 이러한 예들 이외에도, 다른 염-용매 조합들은, 이전에 일정한 염 농도에서 배터리 전해질로서 비효율적인 것으로 간주되었던 것들조차도, LHCE들에 대해 추가로 탐구할 가치가 있다.
앞서 언급한 바와 같이, HCE를 희석하는 목적은 최종 생성물(LHCE) 내의 전체 염 농도를 감소시키되, HCE 내의 것과 같이 고농도의 염-용매 클러스터를 유지하는 것이다. 용액 관점에서, 희석제는 HCE에 불활성이어야 한다. 첫째, 희석제는 염에 대해 거의 또는 전혀 용해성을 제공하지 않아야 하고; 둘째, 상분리를 회피하고 명확하고 균일한 용액을 형성하기 위해 희석제는 HCE 내의 용매화 용매와 쉽게 혼화성이어야 하고; 셋째, 희석제는 제형화된 전해질 내의 고농도의 염-용매 클러스터를 보존해야 하고, 즉, 희석제는 HCE의 내부 용매화 쉘의 국부 배위 환경을 유지하기 위해 Li+ 이온에 대한 열악한 용매화 능력을 갖는다(도 1b 참조). 희석제에서 바람직한 다른 특성은 1) 전해질의 전체 점도를 감소시키기 위해 낮은 점도 및 2) 다른 셀 성분, 특히 LMA에 대한 충분한 불활성/안정성을 포함한다. 이러한 요건을 충족하는 여러 HFE는 BTFE 및 1,1,2,2-테트라플루오로에틸-2,2,3,3-테트라플루오로프로필에테르(TTE)와 같은 상이한 염/용매 조합에 기초한 많은 HCE의 희석제로서 사용되어 왔다. 도 1g-1k에 도시된 바와 같이, BTFE 희석제는 용매 DMC와 완전히 다르게 거동한다. BTFE는 Li+ 이온에 배위되지 않고, 대신 농축된 LiFSI/DMC 클러스터를 둘러싸는 Li+ 이온의 1차 용매 외피(1.95Å의 방사상 분포)에 있다. 이러한 HFE 희석제를 사용하는 제형화된 LHCE는, 후술하는 바와 같이, 많은 상이한 배터리 화학 물질에서 셀 성능을 크게 향상시킨다. LHCE에 대한 또 다른 유망한 희석제는 플루오르화 오르토포메이트, 트리스(2,2-트리플루오로에틸) 오르토포메이트(TFEO)이며, 이는 비점 °C(143C)보다 더 높은 비점을 갖는다. 그 결과, Li 부피 팽창도 크게 감소되고 LMBs의 사이클 수명도 크게 연장된다.27 상응하는 HCE보다 LHCE에서 개선된 성능에 대한 기본 메커니즘에 대한 추가 조사는 고농도 클러스터를 둘러싼 희석제 분자가 전해질/전극 간 상 형성에 공동 참여하고 인터페이즈의 특성을 더욱 개선할 수 있음을 나타낸다.38,39 이러한 개선은 BTFE, TTE 또는 TFEO를 사용하는 모든 LHCE에서 발견되지만 셀 성능은 여전히 다른 희석제에 따라 다르다. LHCE에서 희석제의 양도 중요하다. 염/용매 조합의 비율은 주로 용해도에 의해 결정되며, 이상적으로는 포화 또는 거의 포화된 HCE 용액을 형성한다. 그러나 LHCE에서 희석제의 비율은 용액 관점에서 매우 유연하다. 그럼에도 불구하고, 희석제의 양은 셀 성능에 상당한 영향을 미친다: 전체 염 농도, 점도 및 전도도를 변경한다. 서로 다른 시험 조건에서 상세한 연구를 통해, 우리는 상간 특성과 충분한 염 농도 사이의 균형이 실제 조건에서 셀 성능을 결정한다는 것을 발견했다.38


종래 전해질과 마찬가지로 첨가제도 LHCE에서, 특히 Gr 또는 Si를 음극으로 사용하는 LIB에 대해 중요한 역할을 한다. 종래 전해질에 사용되는 첨가제도 LHCE에 채택될 수 있다. EC, 비닐렌 카보네이트(VC) 및 불소화 에틸렌 카보네이트(FEC)와 같은 성막 첨가제는 다양한 LIB에서 셀 성능을 더욱 향상시킬 수 있다. 그럼에도 불구하고, 음이온 분해는 SEI 형성에서 첨가제 희생과 경쟁하므로 선택된 첨가제의 양은 특정 배터리 화학에 대해 신중하게 최적화되어야 한다.
Enable Stable Cycling of Li Metal Batteries
배터리의 높은 비에너지를 고려할 때, 높은 충전 차단 전압에서 Li 금속을 음극으로 사용하고 기존의 Li-이온 삽입 음극을 사용하는 것은 Li 배터리의 에너지 밀도를 증가시키는 매우 유망한 접근법이다. LIB와 마찬가지로, 고전압 Li-이온 삽입 음극과의 호환성을 위해 전해질에서 탄산염, 인산염, 설폰 등을 기반으로 하는 유기 용매가 선호된다. 에테르는 약 1 M 농도의 규칙적인 희석 전해질에서 4 V 이상으로 충전할 때 불안정해진다. 따라서, 기존의 Li-이온 삽입 음극을 사용하는 LMB용 LHCE의 개발에서는 유기 탄산염, 인산염, 설폰 용매가 먼저 조사되었다. 탄산염 용매 기반 LHCE에서는 희석제로서 BTFE와 함께 DMC가 용매-용매로 먼저 선택되었다.12
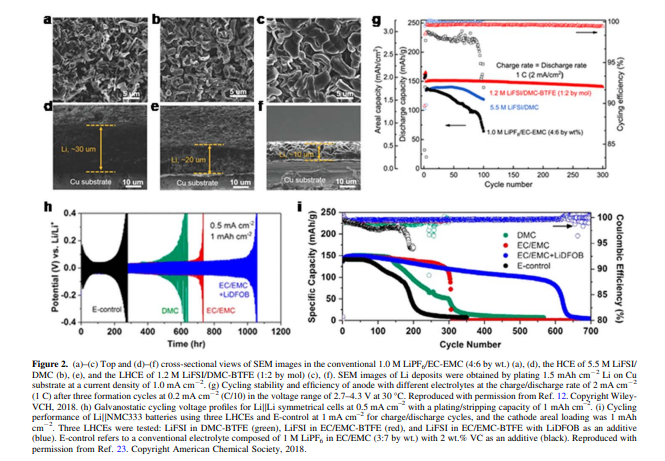
도 2a 및 도 2d에 나타낸 바와 같이, 1.0 M LiPF6/EC-EMC(E-baseline)의 기존 전해질은 수지상 및 느슨하게 패킹된(~30 μm 두께) Li 증착을 초래하였다. 5.5 M LiFSI/DMC의 HCE는 약간 더 큰 크기 및 더 조밀한(~20 μm 두께) Li 증착을 형성하였다(도 2b 및 2e). 증착된 Li는 HCE에 BTFE를 첨가하여 1.2 M LHC를 형성한 후, 5 μm 이상의 크기 및 상당히 조밀한 두께(~10 μm)를 갖는 큰 과립 형태를 보였다(도 2c 및 2f). 이는 LiFSI-DMC-BTFE의 LHCE가 표면적이 작고 전해질과의 부반응이 훨씬 적은 균일하고 조밀한 Li 증착 형태를 만드는 것을 나타낸다. 이 LHCE에 대한 99.3%의 높은 평균 LiCE도 상기 발견을 입증한 반면, 평균 LiCE는 E-baseline의 경우 32.7% 및 5.5 M LiFSI/DMC HCE의 경우 99.2%에 불과했다.
양극 면적 부하가 2.0mAh cm-2, 두꺼운 Li 및 침수된 전해질 양을 갖는 LiNi1/3Mn1/3Co1/3O2(Li ∣∣ NMC333) 셀에서 이러한 전해질을 평가했을 때, LiFSI-DMC-BTFE의 LHCE는 매우 안정적인 사이클링과 더 적은 충/방전 과전위를 허용하여 기준 전해질과 HCE를 크게 능가하였다(그림 2g).

탄산염 기반 LHCE의 LMAs 안정성을 더욱 향상시키기 위해, EC-EMC 용매 혼합물을 사용하여 DMC를 대체하였다. LiFSI-EC-EMC-BTFE의 LHCE는 LiFSI-DMC-BTFE의 LHCE보다 Li ∣∣ Li 대칭 셀과 Li ∣∣ NMC333 셀에서 더 긴 사이클링 안정성을 나타냈다. LiFSI 염의 일부를 LiDFOB로 대체한 후, 용매로서 이중 염 기반 LHCE는 Li ∣∣Li(도 2h) 및 Li ∣∣ NMC333 셀(도 2i)의 훨씬 더 나은 사이클링 성능을 산출했다. 수지상 및 이끼상 Li는 LMB의 반복된 충방전 사이클 동안 양극 표면에 형성되고 축적되기 때문에, 특히 가연성이 높은 전해질이 LMB에 사용될 때, 짧고 심각한 안전 문제의 위험이 증가한다. 인화성 전해질의 잠재적인 안전 위험을 줄이거나 제거하기 위해, 인화성이 낮은 LMB용 LHCE를 조제하기 위해 인산염과 같은 난연성을 갖는 유기 용매를 선택하였다. 도 3b에 나타낸 바와 같이, TEP-BTFE에서 1.2 M LiFSI의 LHCE는 점화될 수 없는 반면, EC-EMC(3:7 wt.) +2 wt.% VC에서 1.0 M LiPF6의 기존 전해질은 쉽게 점화되어(도 3a) 인산염 용매 기반의 제형화되지 않음을 입증하였다. 이 TEP-LHCE는 또한 Li가 큰 입상 입자(도 3c)로 증착될 수 있게 하였으며(도 3d), 0.5 mA cm-2에서 99.2%의 높은 Li CE에서 Li 금속(도 3d)으로 우수한 안정성을 보였다. Li ∣∣ NMC622 코인 셀에 적용되었을 때, TEP-LCE는 활성화되었다. 설폰은 고전압에서 안정하다는 것은 잘 알려져 있지만, 설폰 구조에 대한 S6+의 높은 원자가는 쉽게 감소될 수 있기 때문에 Li 금속에서는 안정하지 않다. 희석 전해질인 LiFSI-8TMS는 Li ∣∣Cu 셀에서 매우 낮은 LiCE(<80%) 및 열악한 사이클링 안정성을 보였다(Fig.4a).24 고농도에서 전해질 LiFSI-3TMS는 98.2%의 평균값으로 상당히 높은 LiCE를 나타내었고 더 나은 사이클링 거동을 보였다. LiFSI-3TMS-3TTE의 LHCE를 만들기 위해 LiFSI-3TMS의 HCE에 희석제로서 TTE를 첨가한 후, 평균 LiCE는 98.8%로 증가하였고 안정성은 크게 향상되었다. 이들 전해질을 Li ∣∣ NMC333 셀에 채용하였을 때, TMS 기반 HCE와 TMS 기반 LHCE 모두 기저 전해질과 희석 LiFSI-8TMS 전해질보다 훨씬 더 우수한 장기 사이클링 안정성을 보였고, TMSLHCE는 TMS-HCE보다 더 우수한 성능을 보였다(Fig.4b).

이전 섹션에서 나타낸 바와 같이, 용매의 전기화학적 산화 안정성은 염-용매 복합체에 통합함으로써 크게 향상될 수 있다. 우리는 최근 이것이 에테르 용매에도 적용된다는 것을 발견했다. 28
에테르 용매 DME 기반 HCE를 TTE로 희석했을 때, LHCE 생성물인 LiFSI-1.2DME-3TTE는 99.3%만큼 높은 평균 Li CE를 생성했다. 이를 사용한 Li ∣∣ NMC811 셀은 4.4 V 및 심지어 4.5 V에서 안정적이었다. 이 성능은 동일한 조건에서 DME-HCE 및 기존의 LiPF6/카보네이트 전해질의 성능보다 훨씬 우수하다: 매체 부하 캐소드(1.5 mAh cm-2), 두꺼운(450 μm) Li 애노드 및 과량의 전해질 (75 μl) (그림 5A, a,b). 이 DME-LCE는 또한 Li ∣∣ NMC811 셀이 155 사이클 동안 안정적으로 사이클링되고 실제 조건에서 여전히 80%의 용량을 유지할 수 있게 해주었는데, 이는 얇은 (50 μm) Li 애노드 및 린 전해질 (14 μl)을 갖는 고부하 캐소드(4.2 mAh cm-2)를 의미한다. 대조적으로, DME-HCE를 사용하는 셀은 용량이 80% 미만으로 떨어지기 전에 단지 102 사이클에 도달했다 (그림 5A, c). 얇은 Li 애노드가 이후 구리(Cu) 기판으로 대체되었을 때, DME-LHCE를 갖는 이 "무음극" Cu ∣∣ NMC811 셀은 77%의 용량 유지율로 70 사이클을 달성했다 (그림 5A, d). 사이클링된 NMC811 캐소드 및 LMA는 SEM (그림 5B 및 5C) 뿐만 아니라 X선 광전자 분광법 (XPS), 환형 광시야 투과 전자 현미경 (ABF-STEM)에 의해 분석되었다. 이러한 분석은 두 가지 주요 결과를 제공했다. 첫째, DME-LHCE는 더 얇고 균일한 캐소드 간 전해질을 생성했다. M-O 신호의 부재는 High-Ni NMC 양극 상에 고급 CEI를 형성하는 DME-LHCE의 능력 및 양극을 보호하기 위한 이 CEI의 효과를 입증하였다. 둘째, DME-LHCE는 또한 긴 사이클링(250 사이클) 후에 큰 과립 입자로서 Li 형태를 효과적으로 유지하였다(도 5C, f). 대조적으로, HCE 및 종래의 전해질은 Li 금속 표면의 심각한 부식을 허용하였다. SEI는 염 음이온 및 DME 용매의 분해로부터 높은 Li 및 O 함량 및 배지 S 및 F 함량(도 5C, c)으로 구성되었다. SEI의 내부 측면의 약간 더 높은 S 및 F 함량(Li 금속에 가까운)은 전해질 성분에 의한 공격으로부터 LMA의 더 나은 보호를 나타낼 수 있다.

Application of LHCEs in Silicon and Graphite Based Lithium Ion Batteries
위에서 설명한 바와 같이, LHCE의 독특한 용해 구조는 확장된 양극 안정성 및 LMAs 상의 효과적인 SEI 형성과 같은 몇 가지 흥미로운 특성을 제공했다. 이러한 이유로, LHCE는 LMBs에서 기존의 LiPF6-유기탄산 전해질에 비해 우수한 전기화학적 성능을 달성했다. 그러나 LMBs에 그들의 대규모 적용 전에 여전히 극복해야 할 상당한 장벽이 있다. 다른 한편으로, LHCE의 독특한 장점은 Gr- 또는 Si/Gr 기반 LIB와 같은 상업적으로 이용 가능한 에너지 저장 시스템에서도 사용될 수 있다. 이 섹션에서는 Gr- 및 Si/Gr 기반 배터리 시스템에서 LHCE의 적용 가능성에 대해 논의한다. LHCE의 용해 피복의 구조 및 구성이 어떻게 Gr 또는 Si/Gr 전극에서 효과적인 SEI의 형성을 용이하게 하고 LIBs의 전기화학적 성능에 영향을 미치는지 밝히기 위해 미시적 분석이 사용될 것이다.
LHCE가 있는 LMB는 높은 차단 전압에서 작동할 때 우수한 전기화학적 성능을 나타내기 때문에 LIB에 사용된 일반적인 양극 물질과 LHCE의 호환성이 입증되었다. 따라서 LHCE와 음극 Gr 또는 Si/Gr 사이의 호환성은 LIB에 LHCE를 적용하는 데 핵심이다. 따라서 주로 Gr 및 Si/Gr 전극에 대한 SEI 형성에 초점을 맞출 것이다. Si의 이론적 비용량이 높기 때문에 Si/Gr 복합 물질은 현재 순수한 Gr 전극을 넘어 가장 실용적인 음극으로 간주된다. Si는 Li 및 Gr 모두와 전극으로서 몇 가지 유사점을 공유한다. Li 전극과 마찬가지로 Si 전극은 리튬화/탈리튬화 동안 상당한 부피 변화를 겪으며, 이는 반복적인 SEI 파괴 및 재생으로 이어진다. Gr과 유사하게 Si 전극은 일반적으로 전해질에 대해 화학적으로 안정한 것으로 간주된다. 따라서 Si 상에서 SEI의 형성은 주로 전기화학적 공정이다. 즉, Si 성능은 Li와 Gr의 성능 사이의 중간 정도로 간주될 수 있다. LHCE는 Li 및 Gr 전극 모두와 우수한 호환성을 나타내기 때문에 LHCE는 Si 또는 Si/Gr 전극과도 호환될 것으로 예상된다.
Si 기반 LIB에서 LHCE의 적용 가능성—그림 6에 나타낸 바와 같이, Si/Gr ∣∣ NMC333 셀의 사이클링 성능과 C-rate 능력은 모두 기존의 LiPF6-유기탄산 전해질을 LHCE로 대체함으로써 상당히 개선되었다. 500회 충방전 사이클 후, 기존 전해질 (E-control-3)과 NFE-1을 사용한 Si/Gr ∣∣ NMC333 셀의 용량 유지율은 각각 50.3%와 65.7%였다. 소량의 FEC를 NFE-1 (생산 NFE-2)에 도입하면 셀의 사이클 수명을 크게 향상시킬 수 있다. 600회 충방전 사이클 후 Si/Gr ∣ NFE-2 ∣ NMC333 셀에서 89.8%의 용량 유지율이 달성되었다. 29 사후 분석 결과, 매우 효과적인 전극/전해질 인터페이즈의 형성이 이러한 개선의 근본적인 메커니즘임을 보여주었다.
NFE-1 및 NFE-2(특히, NFE-2)의 경우, LiF가 풍부한 SEI가 형성되며, 이는 Si 입자의 상당한 부피 변화를 억제하는데 유익하다. E-control-3의 LiPF6가 NFE-1 및 NFE-2에서 화학적으로 더 안정한 전도성 염(LiFSI)으로 대체되기 때문에, 이러한 LHCE에서는 HF 발생이 상당히 억제된다. HF는 양극 물질의 상변화 및 전이금속의 용해와 같은 노화 과정을 유발하거나 촉진하기 때문에, HF와 관련된 노화 과정은 LHCE에서 효과적으로 회피될 수 있다. TEM에 의해 확인된 바와 같이, 양극 물질의 해로운 상전이는 LHCE에서 완화된다. LHCE에서 보다 효과적인 전극/전해질 계면의 형성은 다양한 시험 조건에서 전기화학적 성능을 상당히 향상시켰다. TEP 기반 LHCE 이외에도, 카보네이트 기반 LHCE는 Si/Gr ∣∣ NMC811 물질에서 우수한 사이클링 성능도 가능하게 할 수 있다. Jia et al. 은 최근 Si/Gr ∣∣ NMC532 셀이 최적화된 카보네이트 기반 전해질로 200 충방전 사이클 후 81.8%의 용량을 유지할 수 있다고 보고하였다(Fig.7). 유사하게, 사후 분석은 양 전극 상에 효과적인 전극/전해질 계면의 형성이 개선된 전기화학적 성능의 주요 원인임을 나타낸다.
Gr 기반 LIB에서 LHCE의 적용—Si/Gr 기반 LIB 외에도 LHCE는 Gr 기반 LIB에서의 성능도 향상시킬 수 있다. Gr 입자의 그래핀 층은 약한 반데르발스 힘에 의해 결합되므로, 효과적인 SEI의 부족은 그래핀 층으로의 용매의 공동 삽입을 쉽게 유도할 수 있고, 결과적으로 Gr의 박리를 초래할 수 있다. LIB에서 가역적인 충전/방전 프로세스를 달성하기 위해서는 Gr 상의 효과적인 SEI의 형성이 필수적이다. 3D 모델에 따르면, Gr 상의 SEI 형성은 3개의 연속적인 단계를 포함한다: 1) 양이온-용해 시스를 Gr로 공동 삽입, 2) Gr 인터칼레이션 화합물의 형성 및 3) 양이온-용해 시스의 전기화학적 분해 및 SEI.2,44 이 모델은 Li+의 용해 시스가 Gr 상의 SEI 형성에 대한 지배적인 인자임을 나타낸다. 따라서, LHCE에서 SEI 형성을 이해하는 것은 이의 미세한 용해 구조를 이해하는 것을 필요로 한다. LHCE에서 Li+의 용해 구조는 이 작업의 초기에 자세히 설명되었다. LHCE의 Li+, 음이온 및 용매 분자는 희석제 분자에 의해 분리되는 클러스터를 형성한다. 비배위 용매가 부족하기 때문에 상당한 비율의 Li염이 용해 시스에서 해리되지 않은 Li+-FSI-이온 쌍으로 존재한다. 결과적으로, 상당한 비율의 음이온은 용해 시스에 의해 Gr로 "끌어질" 수 있기 때문에 정전기적 반발력을 극복하고 SEI 형성에 참여할 수 있다. 해리되지 않은 Li염이 SEI 형성 프로세스에 참여할 수 있기 때문에, 이전에는 효과적인 SEI를 형성할 수 없기 때문에 자격이 없는 것으로 간주되었던 용매는 이제 Gr 기반 LIB의 전해질에 사용될 수 있다. 예를 들어, 비록 TEP(도 8에 도시된 바와 같이 TEPa라고도 함)가 종래의 LiPFon6-organabon-organabon의 효과적인 난연제로 사용되어 왔지만. 그러나 LHCE를 채택하면 TEP를 주 용매로 사용하더라도 Gr 전극에 효과적인 SEI를 형성할 수 있다. 소량의 SEI 형성 첨가제, 예를 들어 EC, VC 또는 FEC를 LHCE에 도입하여 Gr 기반 LIB의 사이클링 성능을 더욱 향상시킬 수 있다. 전해질 첨가제 도입의 효능이 우수하다. LiFSI-TEP-BTFE 전해질에서 소량의 EC 첨가는 장기에 걸쳐 Gr 입자의 부분적 박리를 효과적으로 억제한다(Fig.8c.31). 이는 LHCE에서 solvation shees의 조성을 조절하는 것이 LIB의 에너지 밀도와 수명을 증진시키는 데 매우 효과적인 접근법임을 나타낸다.

TEP 외에도 탄산염 용매를 사용하여 Gr ∣∣ NMC LIB에서 우수한 사이클링 성능을 구현할 수 있는 LHCE를 형성할 수도 있다. 예를 들어, Zhang et al. 은 Gr ∣∣ NMC811 셀 화학에서 LiFSI-DMC-Additive-TTE 기반 LHCE의 적용을 보고했다(그림 9A).32 DMC 기반 LHCE를 사용한 셀은 광범위한 작동 온도(-40°C ~ +60°C)에서 우수한 전기화학적 성능을 나타냈다. TEM에서 확인한 바와 같이, 매우 효과적인 SEI와 CEI는 Gr ∣∣ NMC811 셀의 우수한 사이클 수명을 담당한다(그림 9B). 리튬 및 망간이 풍부한(LMR) 물질을 기반으로 한 LIB와 같은 다른 셀 화학에서 DMC 기반 LHC의 적용 가능성은 후속 연구에서도 검증되었다. 100회 충방전 사이클 후, DMC 기반 LHCE는 25°C, 45°C 및 60°C에서 각각 91.7%, 67.9% 및 54.0%의 용량 유지율을 달성하여 동일한 조건에서 E-baseline [EC-EMC 중 1.0 M LiPF6 (3:7 x wt) + 2 wt% VC]를 사용하는 셀의 용량 유지율을 약 2배 증가시켰다. Gr ∣∣ NMC811 셀과 마찬가지로, 사후 분석 결과 LHCE에서 매우 효과적인 전극/전해질 인터페이즈가 형성되어 Gr 기반 LIB에서 LHCE의 다재다능성이 확인되었다. 독특한 용해 피복은 LHCE가 Si/Gr 및 Gr에 우수한 SEI를 형성할 수 있도록 한다. TEP와 같은 Gr 기반 셀 화학에 부적합하다고 간주된 용매는 LHCE의 개념을 채택함으로써 주요 용매로 자격을 얻을 수 있다. 용해 첨가제에 소량의 전해질 피복을 통합한다.

Conclusion
이 작업에서, 국부적 고농도 전해질(LHCE)의 설계를 위한 기본 원리 및 그 응용에 대해 간략하게 검토하였다. LHCE는 고농축 전해질의 장점뿐만 아니라 저농도 전해질의 낮은 점도 및 저비용을 나타낸다. 더 나아가, 이들 전해질은 저온에서 불연성 및 안정성이 되도록 조정될 수 있다. LHCE는 또한 고전압 LMB의 안정성을 크게 향상시킬 수 있다. 이들 배터리의 우수한 성능은 주로 LMA 상에 무기물이 풍부한(예를 들어, LiF 및 Li2O) SEI 및 이들 전해질 내 CEI의 형성에서 기인한다. 이들 전해질 중 일부에서 생성된 단일 SEI는 모자이크 또는 다층형 SEI와는 크게 다르다. 이들 전해질은 LMA의 안정성을 향상시킬 뿐만 아니라 양극의 층상 구조에서 암염 구조으로의 상변환을 크게 억제하고 벌크 양극으로부터 전이 금속 원소의 용출를 방지할 수 있다. 그로 인해, 안전성 우려 감소와 함께, 장기 사이클링 안정성 및 고율 능력 측면에서 우수한 셀 성능이 고전압 LMB에서 실현된다. LMB 외에도 적절한 첨가제를 갖는 LHCE는 Si 또는 Gr 기반 LIB에서도 우수한 성능으로 이어졌다. 이들 전해질, 특히 LHCE와 선택된 첨가제의 조합의 최적화는 이들 Li 배터리 및 기타 배터리 시스템의 성능을 더욱 향상시킬 수 있다.




